I sottotipi IC hanno paesaggi CNA distinti (dati estesi Fig. 1j), ma il loro panorama SV e la loro evoluzione non sono stati studiati. Sfruttando ENiClust, abbiamo scoperto che il panorama genomico specifico del sottogruppo IC del cancro al seno è coerente durante tutta la progressione della malattia, nonostante un aumento del carico di alterazioni10,13,16,17 (Fig. 2a e dati estesi Fig. 2a,b). Entrambi HER2+ ed E.R+ i tumori primari e metastatici ad alto rischio mostrano forti aumenti caratteristici del carico di SV nei rispettivi loci amplificati ricorrenti (IC5: 17q12; IC6: 8p11; IC2: 11q13; IC1: 17q23). Il picco del carico SV a 17q12 (ERBB2) lo suggerisce ERBB2 l’amplificazione è alimentata da alterazioni complesse, come l’ecDNA18. Il carico mutazionale nel RE primario+ i tumori a rischio tipico erano minimi (Figura 1i supplementare) ma aumentavano nella malattia metastatica (Figura 2a), in parte a causa del trattamento (Dati estesi Figura 2c). IC10 e IC4ER− i tumori mostrano un’instabilità diffusa a livello dell’intero genoma con un aumento del carico di SV, sebbene questi ultimi mostrino un modello attenuato e ospitino meno SV patogeni e alterazioni nei percorsi di riparazione del DNA, confermando rapporti precedenti19 (Dati estesi Fig. 2d,e). Nei siti metastatici, il carico cumulativo delle alterazioni era maggiore nelle metastasi polmonari e sottocutanee e inferiore nelle recidive dei tessuti molli e nel seno (Dati estesi Fig. 2f). Queste alterazioni specifiche del sottogruppo sono state osservate nel DCIS (Extended Data Fig. 2a), sottolineando la dipendenza precoce da oncogeni e i meccanismi di trasformazione maligna.
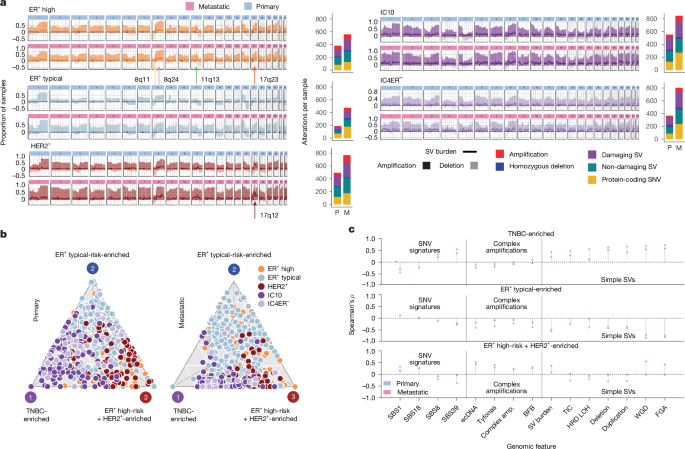
UNprofilo CNA a livello di gruppo IC (area ombreggiata; scuro denota amplificazione, luce denota cancellazione) con carico SV (linea) come sovrapposizione e carico di alterazione totale nei campioni primari e metastatici. BProiezione frontale paretiana sulla trama ternaria dei profili di firma CNA e SV da tumori primari (a sinistra) e metastatici (a destra) in modo indipendente, risultando in tre archetipi genomici. Ogni cerchio tracciato rappresenta un tumore. CTrame di Lollipop che illustrano la correlazione tra le caratteristiche mutazionali e la distanza da ciascun archetipo. amp., amplificazione; BFB, ponte di rottura-fusione; TIC, catena di inserimento modellata; LOH, perdita di eterozigosi; WGD, raddoppio dell’intero genoma; FGA, frazione del genoma alterato.
Successivamente abbiamo caratterizzato le firme CNA e SV in 702 tumori al seno primari, replicando i 24 CNA20 e 6 riarrangiamenti8,21 firme (RS) precedentemente riportate (Figura 2a-c supplementare). RS3, RS5 (associato a deficit di riparazione omologa (HRD); Figura 2d supplementare) e CN17 erano arricchiti nei tumori IC10, mentre RS4, RS6 (associati ad amplificazioni complesse) e CN7 erano arricchiti in ER+ ad alto rischio e HER2+ tumori (Dati estesi Fig. 2g,h e Fig. 2e-g supplementare). E.R+ i tumori a rischio tipico sono stati arricchiti per CN1 (associato a genomi diploidi; Figura 2d, e supplementare).
Proiettati su un piano bidimensionale (Figura 3a,b supplementare), i profili architettonici seguono un continuum e formano un poliedro che ricorda la teoria dell’ottimale di Pareto, che illustra i compromessi tra compiti biologici22. I tumori al seno primari si mappano su tre archetipi genomici dominanti (Fig. 3c-f supplementare): arricchito con TNBC, ER+ tipico-arricchito e ER+ ad alto rischio + HER2+-arricchito. I tumori dominati da un singolo processo mutazionale sono prossimali a un vertice, mentre quelli caratterizzati da più processi si raggruppano al centro (Fig. 2b e Dati estesi Fig. 2i). L’archetipo arricchito con TNBC era correlato positivamente con l’instabilità genomica, gli SNV con modifica HRD e APOBEC (Fig. 2c e Fig. 3g supplementare). Rispetto all’ER+ tumori ad alto rischio, HER2+ i tumori sono stati arricchiti per i tifoni (dati estesi Fig. 2j). Il pronto soccorso+ad alto rischio + HER2+ -l’archetipo arricchito era correlato positivamente con amplificazioni complesse, specie reattive dell’ossigeno e SNV associati ad APOBEC che ospitavano co-amplificazione di più citobande (Dati estesi Fig. 3a). Al contrario, l’ER+ l’archetipo tipico arricchito era correlato negativamente con la maggior parte delle caratteristiche genomiche.
Si prevede che i tumori siano BRCA-simili sulla base delle caratteristiche genomiche della linea germinale o somatica23 mappa all’archetipo arricchito con TNBC (Dati estesi Fig. 3b). Infatti, sia l’ER simile a BRCA1 che quello simile a BRCA2+ ed E.R− i tumori hanno dimostrato punteggi dell’archetipo TNBC significativamente più alti rispetto ai tumori non-HRD e ER simili a HRD+i tumori ad alto rischio erano più vicini all’archetipo arricchito con TNBC rispetto alle loro controparti non-HRD (OR = 5,09; P= 6,5×10−4 ). Inoltre, i modelli mutazionali di ER simili a BRCA1 e BRCA2− ed E.R+ i tumori erano altamente concordanti (Figura 3h,i supplementare). In particolare, mentre il 43,6% dei tumori TNBC erano simili a HRD, il 13,2% dei tumori ER+ Si prevedeva anche che i tumori ad alto rischio fossero simili all’HRD, la maggior parte dei quali erano ER+IC1 o IC9 ad alto rischio (OR = 4,43; P= 0,03; Dati estesi Fig. 3c e Fig. 3j supplementare). Infatti, sebbene le inversioni foldback e i pyrgos fossero arricchiti nel TNBC (inversione foldback: 17,3%, P= 2,00×10−3; Pyrgos: 18,8%, P= 9,33×10−4 ), questi eventi mutazionali sono stati osservati anche in ER+ tumori (5,1% e 4,1%, rispettivamente; Dati estesi Fig. 3d). Questi dati rafforzano molteplici meccanismi di instabilità del genoma nel TNBC24 che influenzano anche un sottoinsieme di ER+ tumori.
I tre archetipi genomici replicati in una coorte indipendente di 2.229 tumori primari di Genomics England21 (Dati estesi Fig. 3e). Nel complesso, il panorama genomico dei tumori mammari primari cade lungo un continuum con modelli mutazionali catturati da tre principali archetipi genomici, vale a dire, genomi diploidi e genoma stabili (ER+ arricchito con rischio tipico), instabilità dell’intero genoma (arricchito con TNBC) e amplificazioni focali complesse (ER+ad alto rischio + HER2+-arricchito).
Le lesioni metastatiche mostrano un aumento del carico SNV e SV rispetto ai tumori primari non appaiati, probabilmente a causa della terapia, come noi e altri abbiamo dimostrato13,17 . Utilizzando l’approccio di cui sopra, abbiamo identificato sei firme SV de novo nelle metastasi correlate a quelle dei tumori primari (Figura 4a, b supplementare) e abbiamo mostrato modelli di arricchimento simili specifici del sottogruppo (Dati estesi Figura 3f). La proiezione bidimensionale ha rivelato nuovamente tre archetipi dominanti (Figura 4c supplementare) che si sovrappongono a quelli dei tumori primari (Figura 2b, c, Figura 3g dei dati estesi e Figura 4d supplementare). I nostri risultati erano robusti rispetto alla scelta dell’algoritmo di riduzione della dimensionalità (Figura 4e-g supplementare). Pertanto, i tre archetipi genomici del cancro al seno sono conservati nella malattia metastatica.
Le firme SV erano generalmente conservate, sebbene aumentate, nei tumori metastatici ad eccezione di RS4 e RS6 in ER+ ad alto rischio e HER2+ tumori, rispettivamente, che erano stabili (Dati estesi Fig. 3h). Questi dati supportano il verificarsi precoce di riarrangiamenti complessi e la loro persistenza attraverso le metastasi. Sebbene la distribuzione delle firme CNA rispecchiasse i tumori primari, il fronte paretiano ha rivelato un aumento del carico di alterazioni e profili più mescolati nelle metastasi, coerenti con un aumento del raddoppio dell’intero genoma e dell’instabilità genomica17 (Dati estesi Fig. 3i e Fig. supplementare 4h,i). Pertanto, i tumori metastatici conservano le cicatrici dei processi mutazionali specifici del sottogruppo operanti nella malattia in stadio iniziale.
Sebbene ER+i tumori a rischio tipico hanno una prognosi favorevole, il 29% dei pazienti presenta una recidiva a distanza4 . Abbiamo studiato se gli archetipi genomici migliorano la stratificazione del rischio. Mappatura METABRIC sul fronte di Pareto (metodi, dati estesi Fig. 3j e Figura supplementare 4j-l), la posizione di ER+ i tumori a rischio tipico erano predittivi di recidiva, con la mappatura dei tumori ricorrenti più vicina al pronto soccorso+ ad alto rischio + HER2+ archetipo (Dati estesi Fig. 3k, l) accompagnato da un punteggio di perdita di eterozigosità HRD più elevato, istologia di carcinoma lobulare invasivo (ILC) e aumento della proliferazione.
In METABRIC, gli ILC sono stati arricchiti in ER+tumori a rischio tipico (OR = 2,20, P= 2,27×10−3 test esatto di Fisher; Figura supplementare 4m). All’interno del pronto soccorso+ tumori ad alto rischio, gli ILC hanno mostrato un rischio di recidiva a 5 anni più elevato (39% contro 30%) e un rischio di recidiva cumulativo più elevato (62% contro 54% a 20 anni; Dati estesi Fig. 3m). Questa differenza era più marcata tra ER+ tumori a rischio tipico (55% contro 37% a 20 anni). Gli ILC erano più vicini al pronto soccorso+archetipo di rischio tipico rispetto alle loro controparti di carcinoma duttale invasivo (IDC) (P= 2,10×10−5; Dati estesi Fig. 3n,o) dati i loro livelli più bassi di raddoppio dell’intero genoma, ploidia e frazione del genoma alterata. Pertanto, date le architetture genomiche comparabili, l’istologia lobulare rimane una caratteristica ad alto rischio.



