Una nuova tecnologia chiamata PAGER consente ai ricercatori di creare recettori personalizzati accoppiati a proteine G.Credito: Juan Gaertner/Libreria fotografica scientifica
I recettori sulla superficie cellulare sono fondamentali affinché le cellule percepiscano e rispondano all’ambiente. Dopo essersi legate a una sostanza chimica specifica all’esterno della cellula, le proteine che attraversano la membrana innescano cascate di segnali o una nuova trascrizione genetica, modificando in definitiva il comportamento cellulare.
I recettori accoppiati alle proteine G (GPCR) – che costituiscono la famiglia di recettori più ampia e diversificata negli esseri umani – sono codificati da almeno 800 geni distinti. Molti GPCR hanno funzioni nel gusto, nell’olfatto e nella percezione della luce e la loro manipolazione fornisce ai ricercatori un modo efficace per controllare l’attività cellulare. Ma farlo spesso comporta un processo scrupoloso di introduzione graduale di mutazioni e di esecuzione di un’evoluzione diretta in un recettore alla volta, il che significa che il potenziale dei GPCR sintetici rimane in gran parte inutilizzato.
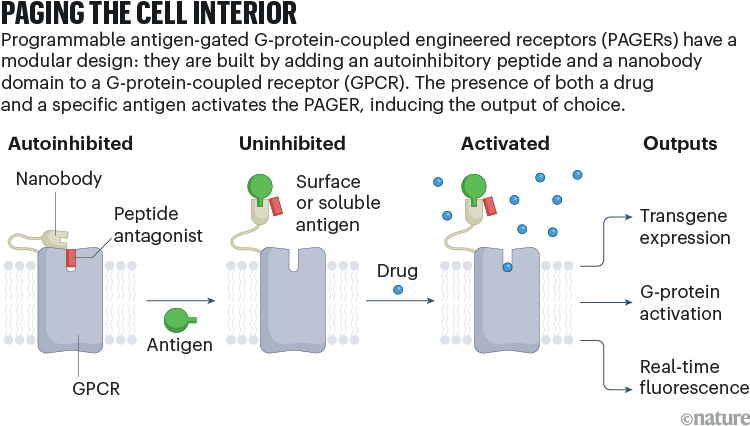
Ora, i ricercatori della Stanford University in California e della Peking University di Pechino hanno sviluppato un sistema modulare e personalizzabile per creare facilmente recettori in grado di rispondere a qualsiasi ligando di interesse e produrre una qualsiasi delle numerose letture possibili. Lo strumento, chiamato recettori programmabili accoppiati a proteine G accoppiati ad antigene (PAGER), è stato descritto in Natura all’inizio di questo mese1 (vedi ‘Cercapersone all’interno della cella’).
Basandosi sui DREADD
PAGER si basa su una tecnologia esistente chiamata recettori designer attivati esclusivamente da un farmaco designer (DREADD). Sviluppati nel 2007 nel laboratorio di Bryan Roth, biologo chimico e sintetico dell’Università della Carolina del Nord a Chapel Hill, i DREADD sono GPCR sintetici che si attivano nelle cellule o negli animali transgenici solo quando i ricercatori somministrano un farmaco specifico. Roth afferma che sono ampiamente utilizzati nelle neuroscienze per “scomporre i circuiti cerebrali responsabili del comportamento e di altre cose”.
Ma lo studio PAGER è la prima volta che Roth vede i ricercatori utilizzare DREADD per creare una nuova tecnologia. “Quando ho ricevuto il giornale e ho iniziato a leggere, ho detto: ‘Porca miseria, perché non ho pensato prima a qualcosa del genere? Questo è fantastico!’”
Per creare PAGER, il team, guidato dalla biologa chimica Alice Ting, ha fuso due componenti nella porzione extracellulare dello scaffold DREADD: un dominio autoinibitore e un nanocorpo (un minuscolo frammento di anticorpo) che si lega a un antigene bersaglio di interesse.
La molecola risultante è “antigen gate”: in assenza di antigene – che potrebbe essere una molecola solubile o fissata sulla superficie di altre cellule – il dominio autoinibitorio blocca la tasca legante il farmaco del recettore, bloccandolo in uno stato “off”. anche in presenza di un farmaco. Quando un antigene si lega al nanocorpo, il dominio autoinibitorio viene spostato e il farmaco può attivare il recettore. Insieme, questi strati di controllo consentono ai ricercatori di regolare le risposte spaziali e temporali nelle cellule che esprimono le proteine PAGER.
Tra le altre cose, afferma Josh Leonard, biologo sintetico della Northwestern University di Evanston, Illinois, lo strumento potrebbe avere benefici clinici consentendo ai ricercatori di regolare la potenza di una terapia o mitigarne l’attività in caso di reazione avversa. “L’ideale sarebbe avere la capacità di attivare o disattivare farmacologicamente tale terapia cellulare”, afferma.
La modularità del sistema PAGER deriva in gran parte dalla sua componente nanobody: poiché i nanobody per diversi antigeni hanno dimensioni e geometria simili, i ricercatori possono facilmente scambiare un nanobody con un altro, per prendere di mira qualsiasi antigene per il quale esiste un nanobody adatto. Il team di Ting ha progettato più di una dozzina di varianti, comprese molecole che potrebbero rispondere a proteine fluorescenti, fattori di crescita e proteine della superficie cellulare.
I ricercatori possono anche personalizzare le conseguenze dell’attivazione del PAGER selezionando uno scaffold con la funzione effettrice a valle appropriata. Il team ha dimostrato progetti che potrebbero attivare un transgene, avviare una cascata di segnali o indurre la fluorescenza come una sorta di sensore.



